CRISPR/CAS是什么?
CRISPR代表"Clustered Regularly Interspaced Short Palindromic Repeats"(成簇規律間隔短回文重復序列)。II型原核生物CRISPR“免疫系統”的發現,使得能夠開發簡單、易用、快速實施的RNA指導的基因組編輯工具。CRISPR首字母縮寫通常發音為“ crisper”。
CRISPR / CAS采用何種工作原理?
CRISPR通路在細菌中被發現,其功能很像免疫系統,可以抵御入侵的病毒和質粒DNA。來自入侵病毒的短DNA序列(間隔區)摻入細菌基因組內的CRISPR基因位點,并充當先前感染的“記憶”。再感染引發互補的成熟CRISPR RNA(crRNA)以找到匹配序列 — 其為CRISPR相關(Cas)核酸酶提供特異性,以在特定 “外源” DNA序列處形成雙鏈斷裂。
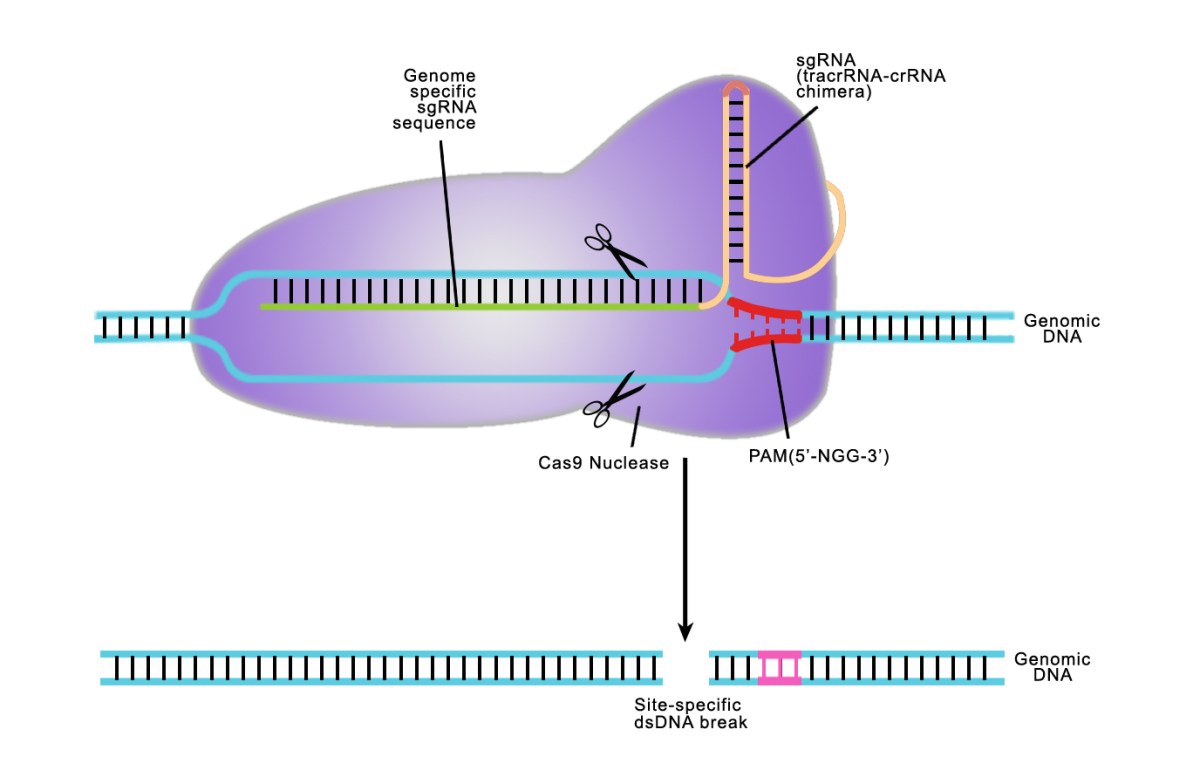
圖 1.基因組靶標位點
CRISPR CAS9采用何種工作原理?
為了創建這樣的工具,內源CRISPR途徑被簡化為兩個主要組分:Cas9核酸酶和指導RNA(gRNA)1-7。導向RNA是由crRNA和tracrRNA組成的雙組分系統。crRNA靶向待切割的雙鏈DNA,并且具有短的同源區域,允許其結合tracrRNA。 tracrRNA提供與Cas9蛋白結合的莖環結構。crRNA:tracrRNA雙鏈體被稱為gRNA。 Cas9核酸酶和gRNA形成Cas9核糖核蛋白(RNP),可以在整個基因組環境中結合并切割特定的DNA靶標。為了被RNP切割,靶必須具有兩個特定序列。首先,gRNA需要17-21個堿基的RNA至DNA同源性,這被稱為前間隔序列。 其次,Cas9蛋白需要有一個短的前間隔序列鄰近基序(PAM),以結合靶DNA(參見圖2)。 如果存在連接tracrRNA,并且在gRNA和基因組靶標之間存在足夠的同源性,則RNP切割靶DNA的兩條鏈,在基因組中的該位置處產生DSB。
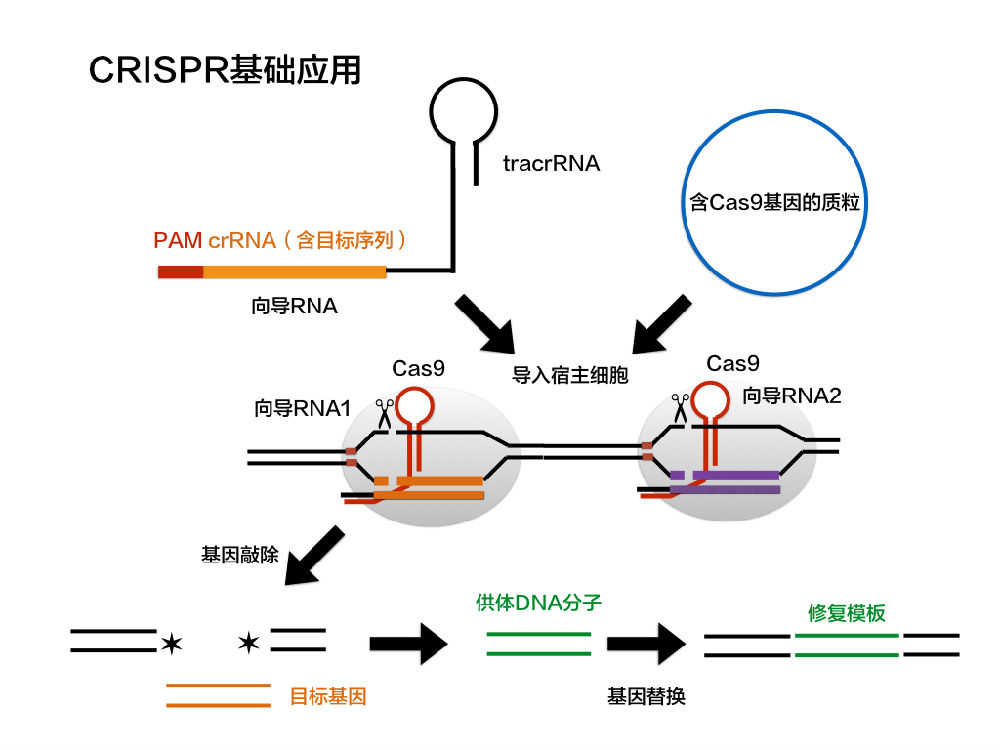
圖 2.CRISPR / Cas靶向雙鏈斷裂的示意圖。
雖然細胞核中的功能性CRISPR是RNP形式,但作為分子工具的CRISPR的組件適合于各種遞送方法。 早期實驗成功地創建了嵌合單指導RNA或sgRNA,其將crRNA和tracrRNA組合成單個RNA鏈而不是天然存在的雙鏈體。 該sgRNA和Cas9 mRNA可以從單個質粒表達,用于直接轉染或包裝成用于慢病毒轉導的顆粒。 也可將重組Cas9蛋白與合成產生的crRNA和tracrRNA組合,以生成RNP轉染或顯微注射給胚胎。
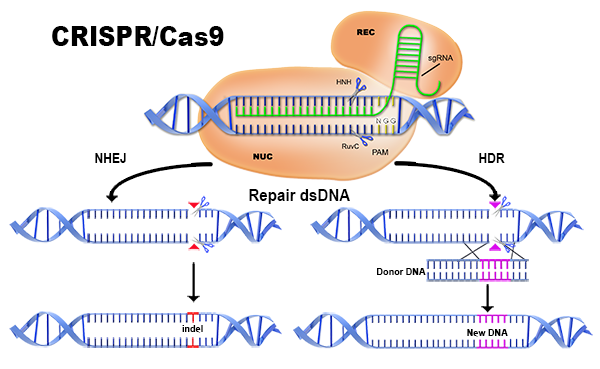
靶向DSB形成后,細胞通常使用兩種DNA修復途徑中的一種來存活:非同源末端連接(NHEJ)或同源依賴性修復(HDR)。這些修復機制經常會出錯,導致在靶位置誘變,或者通過破壞編碼序列來功能性地失活或敲除基因(NHEJ),或者通過添加新的DNA序列來敲入特定的序列變化(HDR)。通過這種方式,CRISPR / Cas9系統能夠對染色體DNA進行的、可遺傳的修飾。此外,當Cas9核酸內切酶結構域失活并附著于其他效應分子以作用于基因組中的gRNA指定位點時,CRISPR系統可用作靶向遞送系統。 這將CRISPR系統功能擴展到基因激活和抑制。zui后,CRISPR系統可用于篩選。CRISPR / Cas9系統的基因敲除、基因敲入、基因激活或抑制、以及篩選這四種主要用途將在下面進一步討論。
基因敲除
當與靶向基因特異的gRNA一起共表達時,CRISPR / Cas9產生敲除細胞或動物模型。基因敲除的目的是通過破壞其在細胞中的表達來揭示基因功能。共表達的適當設計的gRNA指導Cas9切割靶序列,并在目的基因中產生DSB。然后可以通過三種方式中的任何一種實現基因敲除:1)細胞通過NHEJ修復斷裂,導致切割基因的開放閱讀框(ORF)內的隨機插入或缺失(“插入缺失”);2)細胞通過HDR從用戶提供的模板修復斷裂,將特定的破壞性序列插入ORF中;3)一對gRNA產生兩個DSB,其位于基本編碼序列的側翼,導致其切除。
NHEJ是zui活躍的修復機制,但是容易出錯,并且經常引入移碼,導致過早終止密碼子和/或導致所得轉錄物成為無義介導的衰變(NMD)的靶標。移碼修飾可導致過早終止密碼子被引入轉錄物,阻止氨基酸鏈的關鍵部分被翻譯,導致異常短的無功能蛋白質。無義介導的衰變通過消除含有過早終止密碼子的mRNA轉錄物來減少基因表達中的錯誤。 理論上,當外顯子-外顯子連接復合物(也就是RNA剪接期間在外顯子之間的前mRNA鏈上形成的蛋白質復合物)在轉錄物被剪接后未被核糖體適當地去除時,這個監視途徑被激活。當外顯子-外顯子連接復合物由于上游移碼而保持結合時,轉錄物被指示降解,并且功能蛋白質從未被翻譯。這兩種途徑都有效破壞細胞中的基因功能。
基因敲入
CRISPR / Cas9也可用于引入或“敲入”新的DNA序列。常見的修飾包括引入單核苷酸多態性(SNP)、小標簽、loxP或更大的基因盒,例如熒光蛋白。這些修飾是通過特定位置的Cas9誘導的DSB進行的,這顯著增強了靶向整合的機會。靶向整合(基因敲入)通過HDR發生。為了通過HDR進行基因編輯,必須將含有所需序列的DNA “供體” 或修復模板與gRNA和Cas9一起遞送至細胞,通常在供體質粒或寡核苷酸上。基因敲入的效率通常低于敲除(<10%的修飾等位基因),但可用于產生范圍從單核苷酸變化至大插入物的特定修飾。
基因激活和抑制
除了作為基因組編輯工具之外,CRISPR還可以用作其他功能蛋白的靶向遞送系統。Cas9的一個獨特特征是它能夠獨立于DNA切割而結合靶DNA,因為這是Cas9機制的兩個獨立步驟。野生型Cas9具有兩個核酸酶結構域:RuvC和HNH。為了在沒有切割的情況下實現結合,通過誘導點突變(SpCas9中的D10A和H840A)使兩個核酸酶結構域失活,導致核酸酶死亡的Cas9(dCas9)。當與靶向轉錄起始位點的gRNA組合時,發現單獨的dCas9足以通過阻斷轉錄起始來降低或抑制轉錄。在這一發展之后,科學家開始嘗試將轉錄抑制因子和激活因子與dCas9聯系起來。KRAB轉錄抑制結構域已經與dCas9融合,作為效應結構域介導的轉錄沉默的模式。dCas9也與轉錄激活因子和轉錄效應蛋白融合。用于激活的dCas9是廣泛流行的研究領域,并且包括諸如dCas9-VP64、dCas9_SunTag、dCas9-SAM、dCas9-RNA支架和dCas9-VPR的系統。 在我們的產品線中,我們將dCas9與人E1A相關蛋白P300的催化組蛋白乙酰轉移酶(HAT)核心結構域融合。當與靶向轉錄起始位點和增強子區域的gRNA組合時,dCas9-P300指導組蛋白乙酰化,從其異染色狀態釋放DNA,以通過天然染色體環境中的內源細胞機制上調基因表達。dCas9-P300組蛋白乙酰化方法代表了相對于dCas9-VP64或其他類似基因活化基序的獨特作用機制。
篩選
篩選可以快速調查大量候選基因或基因組位點,以參與您的途徑或感興趣的表型。池化寡核苷酸生產和大數據處理的改進,加上慢病毒遞送的效率,使研究人員能夠同時考慮數千個候選基因,無論是作為文庫還是更為集中的子集(panel)。我們將文庫定義為CRISPR克隆的全部基因組集合;而子集(panel)則是較小的基因子集。通常,子集(panel)和文庫可以以兩種形式組裝:池化(在一個管中有數千個gRNA)或排列(在96孔板中每個孔一個gRNA)。這兩種方法都能快速地為更大的問題提供答案,與過去的方法相比具有明顯的優勢,過去的老方法需要一次一個地詢問候選基因,是一個費時費力的過程。
我們提供多種篩選解決方案,包括來自Broad的池化GeCKO文庫,以及Sanger陣列全基因組慢病毒CRISPR文庫,以執行大型基因敲除篩選(8)。并且,人類和小鼠CRISPR / Cas9協同激活調控子(SAM)池化文庫亦即將推出,用于全基因組篩選轉錄激活表型!
上海峰志儀器有限公司提供便攜式熒光蛋白激發光源LUYOR-3415RG,能夠快速篩選熒光蛋白在愈傷、種子、葉片上的表達。現貨供應美國路陽、美國nightsea便攜式熒光光源,能夠篩選綠色熒光蛋白、黃色熒光蛋白、紅色熒光蛋白等多種熒光蛋白的表達。
CRISPR / CAS9是什么?
CRISPR / Cas9系統于1993年被發現,并且顯示在細菌和古細菌生物體內進化,作為對病毒和外來質粒的防御。天然CRISPR途徑的功能是將核酸酶靶向侵入性DNA,產生潛在致命的雙鏈斷裂(DSB)。在識別該途徑的功能后不久,來自細菌化膿性鏈球菌(SpCas9)的II型CRISPR / Cas9系統被重新利用以產生簡單但強大的分子工具,其可被編程以將核酸酶靶向特定的基因組序列。








 添加微信咨詢!
添加微信咨詢!